Forschung

Design und Funktionalisierung neuer Nanodiscs
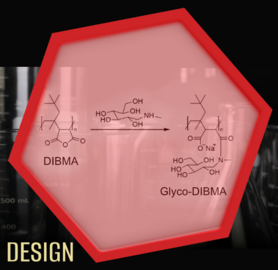
Als Alternative zu traditionellen Detergenzien wurden amphiphile Kopolymere eingeführt. Diese Polymere legen sich wie ein Gürtel um Lipiddoppelschichten und erzeugen so Nanodiscs, die Membranproteine einschließen. Wir haben ein Diisobuten/Maleinsäure-Kopolymer (engl. diisobutylene/maleic acid, DIBMA) als neue Protein-extrahierende Verbindung etabliert, die gegenüber anderen Polymeren entscheidende Vorteile bietet: Die Ordnung von in Nanodiscs eingebetteten Lipidketten wird durch DIBMA nur geringfügig beeinflusst und spektroskopische Untersuchungen von Membranproteinen sind auch im wichtigen ultravioletten Spektralbereich möglich. Außerdem toleriert DIBMA vergleichsweise hohe Konzentrationen divalenter Kationen ohne auszufallen, was wichtig für Aktivitätsuntersuchungen vieler Membranproteine ist. Ein von uns weiterentwickeltes Polymerderivat namens Glyco-DIBMA hat die gleichen günstigen Eigenschaften, erlaubt aber eine noch effizientere Solubilisierung von Lipiden und Extraktion von Membranproteinen. Kürzlich konnten wir zeigen, dass auch manche kleine Moleküle, wie Verbindungen mit einer Diglukose-Kopfgruppe, in der Lage sind Membranproteine und die sie umgebenden Lipide direkt in Nanodiscs zu extrahieren und sie so detaillierten Untersuchungen zugänglich zu machen.
Wir entwerfen neuartige Polymere und kleine amphiphile Verbindungen, um Membranprotein-Nanodiscs für biophysikalische und strukturbiologische Anwendungen zu verbessern.
Biophysik von Membranproteinen in Nanodiscs
Als zweiten Schwerpunkt setzen wir eine große Bandbreite biophysikalischer Methoden ein, um Nanodiscs und die darin eingebetteten Membranproteine und Lipide zu untersuchen. Unser Methodenrepertoire umfasst zahlreiche spektroskopische, kalorimetrische und chromatographische Verfahren sowie Lichtstreuung und mikrofluidische Diffusionsgrößenbestimmung (engl. microfluidic diffusional sizing). Außerdem kommen hochauflösende bildgebende Verfahren wie die Elektronenmikroskopie und Einzelmolekül-Fluoreszenzmessungen sowie Hochdurchsatztechnologien wie die Massenspektrometrie für Proteomics und Lipidomics zum Einsatz. Zusammen bieten diese komplementären Methoden detaillierte Informationen über den Aufbau und die Größenverteilung von Nanodiscs sowie über die Konformation und Dynamik von Membranproteinen und Lipiden.
Wir verfeinern diese Methoden fortlaufend, um sie besser mit Nanodiscs kompatibel zu machen, und nutzen umgekehrt die daraus gewonnenen Erkenntnisse für die gezielte Optimierung von Nanodiscs.
Nanodiscs als Plattform für biomolekulare Anwendungen

Ein besonders wichtiger Aspekt unserer interdisziplinären Forschung ist es, Nanodiscs als vielseitige Werkzeuge für die Beantwortung biomolekularer Fragen einzusetzen. Nanodiscs erlauben sowohl die Isolierung einzelner Proteine und Proteinkomplexe als auch die Gewinnung ganzer Proteinbibliotheken aus unterschiedlichen Organismen und Zellen. Dadurch wird es möglich, Funktions- und Interaktionsstudien unter Laborverhältnissen durchzuführen, die einerseits zwar gut kontrolliert werden können, andererseits aber trotzdem die natürliche Umgebung von Membranproteinen imitieren. Beispielsweise können mithilfe obengenannter Methoden Protein/Protein-Interaktionen innerhalb einer Membranumgebung untersucht werden, ohne dass die Membranproteine für diesen Zweck gereinigt oder rekonstituiert werden müssen. Unsere Nanodiscs werden auch für hochauflösende Strukturanalysen von Membranproteinen mittels Elektronenmikroskopie eingesetzt und können für Ligandbindungsstudien herangezogen werden, was die Identifizierung neuer Wirkstoffe erleichtert.
Wir entwickeln diese Nanodisc-Technologieplattform, um die Strukturen, Dynamiken und Interaktionen von Membranproteinen mit hoher Auflösung in einer der natürlichen Membran ähnlichen Umgebung aufzuklären.
Sandro Keller
Institut für Molekulare Biowissenschaften (IMB)
Humboldtstr. 50/III
8010 Graz
Einige unserer Polymere sind bei GLYCON erhältlich.

